问题描述:
下列装置可用于某些气体(或物质)的制备、干燥、性质的验证和尾气的处理(加热及夹持、固定装置均略去),请回答下列问题(仪器装置可任意选用,必要时可重复使用):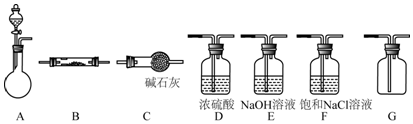
(1)当圆底烧瓶中盛装锌片,分液漏斗中盛装稀硫酸时,可验证H2的还原性并检验其氧化产物.
①仪器的连接顺序为A-D-B-B-C,两次使用B装置,其中所盛的药品依次是CuO、___,证明H2有还原性的现象是___.②检查好装置的气密性后,在加热B之前必须进行的操作是___.
(2)若圆底烧瓶中盛装MnO2、分液漏斗中盛装浓盐酸,B中是纯铁粉,则可选用上述装置制备纯净的FeCl3(FeCl3遇水蒸气发生反应,产生白雾).
①按气流由左向右流动的方向,选择适当的仪器与A相连进行实验,仪器的连接顺序为:A-___-___-___-G-___-___-___.(装置G干燥洁净,可用作收集FeCl2;可以不填满)
②装置A中所发生的离子方程式为___.
③实验过程中,A、B两处均需要加热但不能同时加热,应先加热A一段时间后再点燃B处酒精灯的理由___.
④设计一种方案,验证实验结束后,B装置内固体中仍存在一定量的铁单质___.
(1)①第二次使用B装置的作用是检验产物水,可用无水硫酸铜;氢气将黑色氧化铜还原为红色铜单质,生成水使无水硫酸铜变蓝色;
故答案为:无水硫酸铜;左侧B中黑色物质变红色,右侧B中显蓝色;
②氢气混有氧气时,加热容易发生爆炸,所以加热前应先排尽装置中的空气,通过检验氢气的纯度,来判断,是否除尽;
故答案为:检验氢气的纯度;
(2)①制备氯化铁,FeCl3遇水蒸气会产生白雾,制得氯化铁不能接触到水蒸气,圆底烧瓶中盛装MnO2,分液漏斗中盛装浓盐酸制备氯气,氯气中含有水蒸气和氯化氢,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气和铁加热反应生成氯化铁,氯化铁蒸气在装置G中冷却收集,最后装置连接干燥管C目的是防止空气中的水蒸气进入装置G,则装置的连接顺序为A-F-D-B-G-C;
故答案为:;F;D;B;C;
②A装置中为二氧化锰和浓盐酸制备氯气,离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
③铁易与氧气反应,所以先加热A一段时间用氯气排除装置中的空气,防止加热时氧气氧化B中的单质铁;
故答案为:用氯气排除装置中的空气,防止加热时氧气氧化B中的单质铁;
④铁由磁性,故方法为:取出B装置中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现;
故答案为:取出B装置中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现.

