问题描述:
我国的领海主权不容侵犯,南海是我国的固有领海,蕴藏着丰富的海洋资源.南海某岛采用风力发电提供的电能对海水进行了如图1所示的综合利用.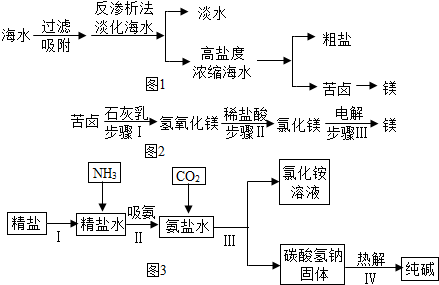
(1)将高盐度浓缩海水进行___可以得到粗盐.某粗盐样品中除含有泥沙等不溶性杂质外,还含有CaCl2和Na2SO4两种可溶性杂质,现欲得到纯净的食盐晶体,需经过多步操作:首先,将粗盐溶于水,为除去不溶性杂质,需要选用的玻璃仪器有___.欲除去食盐水中的CaCl2和NaSO4,应向该食盐水中依次加入___、___(填写化学式),然后过滤:为尽可能除去杂质,每次加入的试剂应___,除去Na2SO4的化学方程式___.然后向所得溶液中加入___(填写化学式)至无气泡产生,再经蒸发结晶得到食盐晶体.
(2)用苦卤制取金属镁的流程图如图2
上述转化过程中,所发生的反应属于复分解反应类型的步骤是___(填序号),步骤Ⅱ的化学方程式为___.利用苦卤制取氢氧化镁比“直接向海水中加入石灰乳制取氢氧化镁”的优势是___.
(3)如图3是海水“制碱”的部分简单流程:
步骤Ⅲ反应的化学方程式是:___.
步骤Ⅳ反应的化学方程式:___.
(1)氯化钠的溶解度受温度影响变化不大,所以将高盐度浓缩海水进行蒸发结晶可以分离得到粗盐;故答案为:蒸发结晶;
除去不溶性杂质可以利用过滤装置分离,用到的玻璃仪器是烧杯、玻璃棒、漏斗,故答案为:烧杯、漏斗、玻璃棒;
欲除去食盐水中的CaCl2和Na2SO4,应向该食盐水中依次加入BaCl2溶液、Na2CO3溶液然后过滤;为尽可能除去杂质,每次加入的试剂应稍过量,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的化学方程式:Na2SO4+BaCl2═BaSO4↓+2NaCl;加入碳酸钠用以除去氯化钙和过量的氯化钡,最后再加入盐酸除去反应剩余的碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,故答案为:BaCl2;Na2CO3;稍过量;Na2SO4+BaCl2═BaSO4↓+2NaCl;HCl;
(2)苦卤加入石灰乳是氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,盐酸和氢氧化镁反应生成氯化镁和水,都是两种化合物相互交换成分生成另外的两种化合物,属于复分解反应;其中盐酸和氢氧化镁反应生成氯化镁和水的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O;利用苦卤制取氢氧化镁比“直接向海水中加入石灰乳制取氢氧化镁”的优势是:苦卤中镁离子的浓度高.故填:Ⅰ、Ⅱ;Mg(OH)2+2HCl=MgCl2+2H2O;苦卤中镁离子的浓度高;
(3)以海水中获得食盐为原料制取纯碱,粗盐水加入石灰乳是氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,
步骤Ⅲ反应的化学方程式是NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3;Ⅳ是碳酸氢钠加热分解为碳酸钠、水和二氧化碳;故填:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3;2NaHCO3
| ||

