问题描述:
研究性学习小组甲对教材实验结论 “ 葡萄糖与新制氢氧化铜反应生成的红色沉淀是氧化亚铜 ( Cu 2 O) ,提出质疑,他们认为红色沉淀不一定全是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是 ① Cu 2 O 。 ② Cu 2 O 和 Cu
查阅资料: ① 氧化亚铜能与酸反应,得到 +2 价的铜盐和单质铜;
② 在空气中灼烧氧化亚铜生成氧化铜;
研究性学习小组 ![]() 甲设计出三种方案来验证猜想
甲设计出三种方案来验证猜想
方案 1 :取该红色沉淀加入稀盐酸中,观察溶液是否变蓝;
方案 2 :取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案 3 :称取红色沉淀 a g ,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为 b g ,比较 a , b 关系;
(1) 葡萄糖的化学式为 ▲ 属于 ▲ ( 填 ” 有机物 ” 或 ” 无机物 ”) 检验葡萄糖用的新制氢氧化铜由硫酸铜溶液与氢氧化钠溶液反应生成 反应的化学方程式为 ▲ ![]()
(2) 根据查阅资料 写出氧化亚铜与稀硫酸的反应方程式 ▲
研究性学习小组甲设计出三种方案你认为合理的方案是 ▲ 。
![]() 研究性学习小组乙设计新的探究方案探究红色沉淀成份,装置如下图所示。
研究性学习小组乙设计新的探究方案探究红色沉淀成份,装置如下图所示。
已知 ① 2NH 3 +3Cu 2 O===N 2 +6Cu+3H 2 O
② 浓氨水与固体 CaO 接触,会逸出大量氨气 碱石灰是氧化钙和氢氧化钠的混合物可吸收水和二氧化碳
方案如下 (1) 连好装置 检查装置气密性
(2) 准确称取 28.8 克的红色沉淀于玻璃管中
(3) 先 A 处反应 通一段时间氨气后称量 D 质量为 108.3 克
(4) 加热装置 C
![]() (5) 待 D 中恒重为 111.9 克时 停止加热 继续通氨气直到装置 C 完全冷却 .
(5) 待 D 中恒重为 111.9 克时 停止加热 继续通氨气直到装置 C 完全冷却 .
 | |||
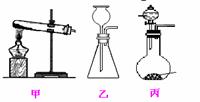 | |||
(3)A 处为用浓氨水与固体 CaO 接触,以产生稳定持续的氨气 则 A 处的发生装置应选 ▲ ( 填 ” 甲 ” ” 乙 ” 或 ” 丙 ”)
(4)B 中碱石灰的作用 ![]() 是 _______ ▲_ ________ ,加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响 还具有一个作用为 ▲ .
是 _______ ▲_ ________ ,加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响 还具有一个作用为 ▲ .
停止加热 继续通氨气除了让生成的铜充分冷却 还有的一个作用为 ▲
(5) 为防止未反应的氨气扩散到空气中 E 处可以连接的装置为 ( 液体均为稀硫酸 从下列选项中选择 ) ▲
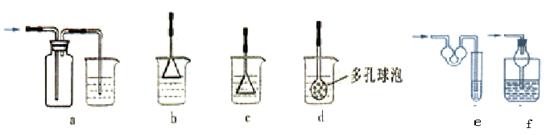
(6) 红色沉淀的成份为 ▲ ( 通过计算说明共 2 分 )
(7) 有同学认为利用此实验装置还可以测定水中氢 . 氧元素的质量比 不过还需要测出一个数据 你认为要测出的数据为 ▲ (从下列选项中选择)
A. 实验所消耗的氨气质量 B. B 中干燥管中增加的质量
C .完全反应后玻璃管中固体质量
(8) 下列情况会使测定水中氢 . 氧元素的质量比偏小的有 ▲ (从下列选项中选择)
A .红色沉淀未完全反应 B .红色沉淀未完全干燥
C .实验中缺少 B 装置 D .实验结束后未等铜完全冷却就拆除装置
(1) C 6 H 12 O 6 有机物 (2) Cu 2 O + H 2 SO 4 ==== Cu +CuSO 4 + H 2 O ...

