问题描述:
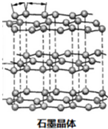
石墨、富勒烯C60、和金刚石的结构模型如图所示(石墨仅表示出其中的一层结构):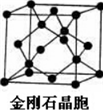
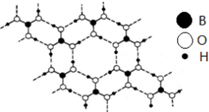
(1)石墨层状结构中,层与层之间作用力为___,片层中平均每个六元环含碳原子数为___个;在层状结构中,平均每个六棱柱含碳原子数___个.正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构.层内的H3BO3分子通过氢键相连(如图).分子中B原子杂化轨道的类型为___,1mol H3BO3的晶体中有___mol氢键
(2)由金刚石晶胞可知,每个金刚石晶胞占有___个碳原子.碳原子杂化类型为___,在该晶体1mol碳平均可形成___molC-C键,砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,每个As与___个Ga相连,且第一电离能As___Ga(填“>”、“<”或“=”)
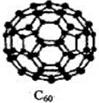
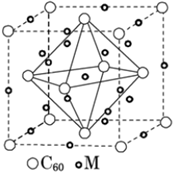
(3)C60属于___ (填“原子”或“分子”)晶体.晶体结构中,C60分子中每个碳原子只跟相邻的3个碳原子形成化学键,1mol C60分子中σ键的数目为___,科学家把C60和M掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示.M位于晶胞的棱和内部,该化合物中的M原子和C60分子的个数比为___.
(1)石墨层状结构中,层与层之间作用力为范德华力,片层中平均每个六元环含碳原子数=
| 1 |
| 3 |
在层状结构中,平均每个六棱柱含碳原子数=12×
| 1 |
| 6 |
根据图知,正硼酸(H3BO3)中每个B原子连接3个O原子且不含孤电子对,据此确定B原子杂化方式为sp2;
1个正硼酸分子能形成3个氢键,则1mol H3BO3的晶体中氢键物质的量是3mol;
故答案为:范德华力;2;2;sp2;3;
(2)金刚石晶胞中C原子个数=4+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:8;sp3;2;4;>;
(3)由分子构成的晶体是分子晶体;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键,每个C原子含有1.5个σ键,1mol C60分子中σ键的数目为90NA;
该晶胞中M原子个数=8+1+12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:分子;90NA;3:1.

