问题描述:
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=___.(请用含有△H1、△H2的式子表示)
(2)若NH3⇌
| 1 |
| 2 |
| 3 |
| 2 |
(3)在体积为3L的恒容密闭容器中,合成氨N2+3H2⇌2NH3实验,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1___T2(填“>”、“<”或“=”)
②在T2下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=___,平衡时N2的转化率α(N2)=___.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
| . |
| M |
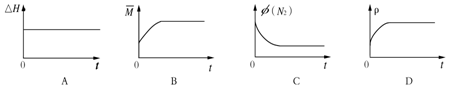
(1)由①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
结合盖斯定律可知,(①×3+②×2)×
| 1 |
| 5 |
| 3△H1+2△H2 |
| 5 |
故答案为:
| 3△H1+2△H2 |
| 5 |
(2)若NH3⇌
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| a2 |
故答案为:
| 1 |
| a2 |
(3)破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则合成氨的反应为放热反应,
①由表格数据可知,T1对应的氨气平衡时物质的量大,则T1的温度低,则T1<T2,
故答案为:<;
②T2K下,经过10min达到化学平衡状态,则
N2+3 H2⇌2NH3,
开始 4 9 0
转化 1 3 2
平衡 3 6 2
v(H2)=
| △c |
| △t |
| ||
| 10min |
平衡时N2的转化率α(N2)=
| 1 |
| 4 |
故答案为:0.1mol•L-1•min-1;25%;
③焓变(△H)始终不变,混合气体平均相对分子质量(
| . |
| M |
| . |
| M |
故答案为:BC.

