问题描述:
氮可以形成多种化合物,如NO、MH3、N2H4、NO2、N2O5等.(1)己知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-12H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1则N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=___ kJ•mol-1
(2)NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)2CO2(g)+N2(g)△H=-akJ•mol-1(a>0),在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化
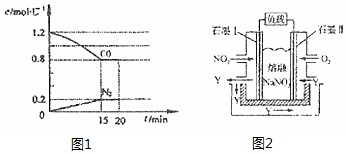
如图1所示:
①0〜15minN2的平均速率v(N2)=___.
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是___(选填序号).
a.缩小容器体积b.增加CO的量 c.升高温度d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___移动(选填“向左”、“向右”或“不”).
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I为电池的___极(正,负),电极I处产生的氧化物Y参与循环,有一部分在电极II处被利用,其利用率为___.
(1)已知①N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,由盖斯定律可知,②-①得N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=(-571.6kJ•mol-1)-(+50.6kJ•m...

