问题描述:
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO 2 (g)+3H 2 (g)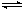 CH 3 OH(g)+H 2 O(g) Δ H 1
CH 3 OH(g)+H 2 O(g) Δ H 1
反应II:CO(g)+2H 2 (g)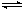 CH 3 OH(g) Δ H 2
CH 3 OH(g) Δ H 2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数( K )
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断Δ H 2________ 0,ΔS______0 (填“>”、“=”或“<”=)。
③对于反应II,若容器容积不变,下列措施可增加甲醇产率的是__________。
| A.升高温度 | B.将CH 3 OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.按原比例再充入 CO和 H 2 |
(2)已知在常温常压下:
① 2CH 3 OH(l)+3O 2 (g)=2CO 2 (g)+4H 2 O(g) Δ H =-1275.6 kJ·mol -1
② 2CO(g)+O 2 (g)=2CO 2 (g) Δ H =-566.0 kJ·mol -1
③ H 2 O(g)=H 2 O(l) Δ H =-44.0 kJ·mol -1 写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式____________________。
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
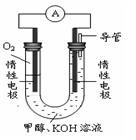
①该电池中OH - 向_______极移动(填“正”或“负”)
②该电池负极的电极反应为_________________________。
③用该电池电解(惰性电极)500mL某CuSO 4 溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH) 2 固体。则原CuSO 4 溶液的物质的量浓度为_______________,电解过程中收集到标准状况下的气体体积为__________________。
(1)①(2分);②<(1分);<(1分);③BD(2分);④80%(2分)、250℃(2分)(2)CH3OH(l)+O2(g)→CO (g)+2H2O(l) △H=-442.8kJ·mol-1(2分)(3)①负(1分);②CH3OH-6e-+8OH-=CO32-+6H2O(2分);③0.2mol·L-1(2...

