问题描述:
CO在人类社会的发展过程中扮演着多重角色.既有其为人类服务”功臣”的一面,也有作为大气重要污染物“罪人”的一面.请回答下列问题:(1)CO是工业冶炼金属的重要还原剂之一,已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3KJ/mol
则CO还原FeO的热化学方程式是___.
(2)工业上可利用甲烷与水蒸气反应制备CO原料气:CH4(g)+H2O(g)═CO(g)+3H2(g).图1是CH4(g)与H2O(g)体积比为1:3时,平衡体系中甲烷的体积分数受温度、压强影响的关系图:
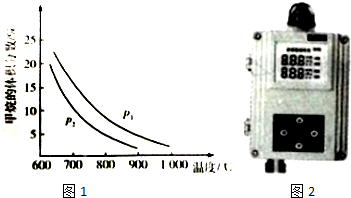
①甲烷与水蒸气制备CO的反应为___(填“放热”或“吸热”)反应,压强:P2___P1(填“>”或“<”).
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,平衡___(填“向正反应方向”“向逆反应方向”或“不”)移动.
(3)CO与水蒸气反应可制备氢气:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0.已知800℃时,在容积为2L的恒容密闭容器中充入0.2mol水蒸气和0.2molCO发生上述可逆反应.经过5min,反应达到平衡状态,此时测得平均反应速率v(CO2)=0.01mol/(L•min),则该温度下的平衡常数K=___,达到平衡时CO的转化率为___.
(4)一氧化碳报警器(如图2)可检测环境中一氧化碳的浓度,其化学反应原理是CO与O2反应生成CO2,其工作原理是当CO通过外壳上的气孔经透气膜扩散到电极上时,在电极表面催化剂的作用下,在水的参与下被氧化,该电极的电极反应式为___.
(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(2)①压强不变,升高温度,化学平衡向着吸热方向进行,甲烷的体积分数减小,所以正向进行,反应是吸热的;温度不变,增加压强,甲烷的体积分数增大,所以P1大;故答案为:吸热;<;
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,相当于体系减压,所以平衡正向移动,故答案为:向正反应方向;
(3)CO+H2O(g)⇌CO2+H2,经过5min,反应达到平衡状态,此时测得平均反应速率v(CO2)=0.01mol/(L•min),得到二氧化碳的变化浓度是0.05,
初始浓度:0.1 0.1 0 0
变化浓度:0.05 0.05 0.05 0.05
平衡浓度:0.05 0.05 0.05 0.05
化学平衡常数K=
| 0.05×0.05 |
| 0.05×0.05 |
| 0.05 |
| 0.1 |
故答案为:1;50%;
(4)CO与O2反应生成CO2的燃料电池负极上是燃料燃烧的反应,即CO+H2O-2e-=CO2+2H+,故答案为:CO+H2O-2e-=CO2+2H+.

