问题描述:
实验室常用二氧化锰与浓盐酸来制备氯气,反应原理为:MnO2+4HCl(浓)
| ||
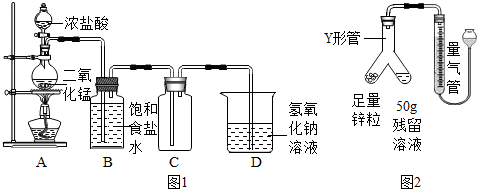
【查阅资料】
①氯气是黄绿色且有毒的气体,难溶于饱和食盐水;
②氯气能与氢氧化钠溶液反应,生成氯化钠、次氯酸钠(NaClO)和水;
③常温常压下,氢气的密度为0.09g/L.
【回答问题】
(1)装置B的作用为___;
(2)根据装置C判断,氯气的密度比空气___(填“大”或“小”);
(3)装置D的作用为___(用化学方程式表示)
【发现问题】
制备过程中,因盐酸浓度下降导致反应停止,某化学兴趣小组同学为测定装置A中反应后残余液中HCl的质量分数,提出两套测定方案如图3所示
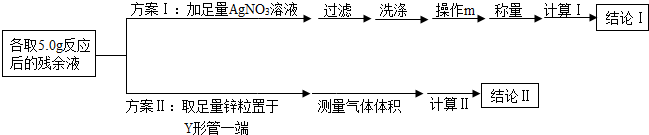
(4)方案Ⅰ中操作m的名称为___,通过称量生成沉淀的质量,计算出残余液中HCl的质量分数,此测定方案是___(填“可行”或“不可行”)的,原因是___;
(5)方案Ⅱ利用图2装置(固定仪器的装置已略)进行测定.
①实验过程中观察到锌粒表面有气泡产生,反应的化学方程式为___;
③当装置恢复至常温时,测得反应生成气体的体积为183.5mL,根据化学方程式计算,残余液中HCl的质量分数为多少?
【反思讨论】
(6)为了保证方案Ⅱ测定结果的准确性,正确操作是:倾斜Y形管,___(填标号)
A.将残余溶液转移到锌粒中 B.将锌粒转移到残余溶液中
(7)Y形管内空气对气体体积的测量___(填“有”或“没有”)影响.
(1)二氧化锰与浓盐酸来制备氯气,制取的气体中常混有挥发出的氯化氢气体,装置B的作用为除去氯化氢气体;
(2)根据装置C判断,气体长进短出,说明气体的密度比空气大;
(3)氯气有毒,排放在空气中会造成污染,故用氢氧化钠溶液吸收,反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
(4)方案Ⅰ:方案Ⅰ中操作m的名称为干燥;二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故不能用来测定残余液中盐酸的质量,反应不可行;
(5)①方案Ⅱ:将锌转移到残留溶液中,反应的方程式为:Zn+2HCl=ZnCl2+H2↑;
③ 设残余液中的HCl的质量为x
Zn+2HCl=ZnCl2+H2↑
73 2
x 0.09 g/L×0.1835 L
| 73 |
| x |
| 2 |
| 0.09g/l×0.1835l |
X=0.6 g
残余液中HCl的质量分数:
| 0.6g |
| 5g |
答:残余液中的HCl的质量分数为12.0%;
(6)将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
(7)氢气的密度比空气小,故Y形管内空气对气体体积的测量没有影响.
故答案为:(1)除去氯气中混有的氯化氢气体
(2)大
(3)Cl2+2NaOH═NaCl+NaClO+H2O
(4)干燥(或烘干) 不可行
残余液中的MnCl2也能与AgNO3溶液反应生成沉淀,造成测量值偏大
(5)①Zn+2HCl=ZnCl2+H2↑
③ 设残余液中的HCl的质量为x
Zn+2HCl=ZnCl2+H2↑
73 2
x 0.09 g/L×0.1835 L
| 73 |
| x |
| 2 |
| 0.09g/l×0.1835l |
X=0.6 g
残余液中HCl的质量分数:
| 0.6g |
| 5g |
答:残余液中的HCl的质量分数为12.0%.
(6)B (7)没有

