问题描述:
在实验室中,氯化氢常用固体氯化物与浓硫酸在加热条件下反应制得,例如用NaCl与浓H 2 SO 4 在加热条件下反应,其化学方程式为: 2NaCl+H 2 SO 4 (浓)![]() Na 2 SO 4 +2HCl↑
Na 2 SO 4 +2HCl↑
氯化氢密度较空气大,极易溶于水,其水溶液为盐酸。
现用实验室制氧(KClO 3 与MnO 2 混合加热)后的剩余固体为原料,制取氯化氢并溶于水制得盐酸。
(1)本实验在制氯化氢之前必须把MnO 2 除去,其原因是__________________________。
(2)写出制取氯化氢的化学方程式:___________________________________________。
(3)实验的步骤是_______________________________________________________。
(4)制取氯化氢气体所用装置与制______________________________相同。其主要玻璃仪器为________________________________________________________________。
(5)收集氯化氢气体应用_______________________。检验一个集气瓶中是否已收集满氯化氢气体,其方法是_____________________________________。若要使氯化氢气体溶于水中制得盐酸,吸收装置可用图中的___________________________________________。
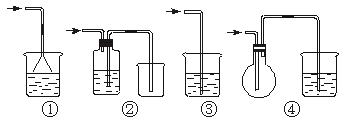
(1)若不除去MnO 2 ,制得的HCl将被MnO 2 氧化生成氯气
(2)2KCl+H 2 SO 4 (浓) ![]() K 2 SO 4 +2HCl↑
K 2 SO 4 +2HCl↑
(3)溶解、过滤、蒸发、结晶、制气
(4)Cl 2 酒精灯、分液漏斗、圆底烧瓶
(5)向上排空气法 可用湿润蓝色石蕊试纸在集气瓶口检验,若试纸显红色则已收集满氯气 ①②

