问题描述:
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)⇌2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
起始时乙中的压强是甲容器的___倍,乙的平衡常数为___
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是___(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
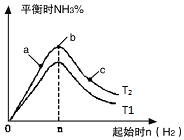
①像中T2和T1的关系是:T2___T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是___(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为___.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q___110.88kJ(填“>”、“<”或“=”).
(1)甲、乙两组实验中同种物质的体积分数相同,说明达到相同的平衡状态,乙容器体积V,1.5mol5L=1.2molV,V=4L;根据三段式:甲:N2+3H2⇌2NH3,起始量 2 3 0变化量 0.75 2....

