问题描述:
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.已知:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1
H2O2(l)═H2O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g)△H=44kJ•mol-1
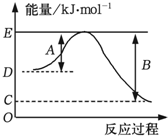
(1)试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)化学键的键能是指气态原子间形成1mol化学键时释放的能量.下表列出了某些
化学键的键能:
| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
①如图表示某反应的能量变化关系图,此反应为___(填“放热”或“吸热”)反应,其中△H=___kJ•mol-1(用含C和D的字母表示);
②若此能量变化关系图表示如下反应:H2(g)+
| 1 |
| 2 |
(1)①N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1①
H2O2(l)═H2O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98kJ•mol-1)+4×(+44kJ•mol-1)=-642 kJ•mol-1
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642 kJ•mol-1;
(2)①反应物能量高于生成物,正反应放热;△H=-(反应物总能量-生成物总能量)=-(D-C)KJ/mol=(C-D)KJ/mol,
故答案为:放热;(C-D);
②B表示1mol水的键能,为2×463KJ/mol=926KJ/mol;△H=反应物键能和-生成物键能和=436KJ/mol+
| 1 |
| 2 |
故答案为:926;496.4;

