问题描述:
氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图: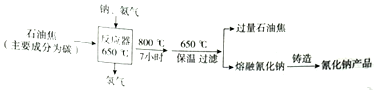
(1)制备过程的化学反应方程式为___.
(2)工厂中,氰化钠存储区应贴的标志图1为___(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为___.
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是___(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=___(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为___.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为___.除去CN-的离子反应方程式为___.
(1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气,反应为:2Na+2C+2NH3
| ||
故答案为:2Na+2C+2NH3
| ||
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为:
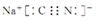 ;
;故答案为:
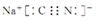 ;
;(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O⇌HCN+OH-;Kh=
| Kw |
| Ka |
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.

