问题描述:
实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.(1)已知:2CO(g)+O2(g)=2CO2(g)△H1=-566kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H2=-484kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-802kJ•mol-1
则△H0=___kJ•mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)V12CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图1.
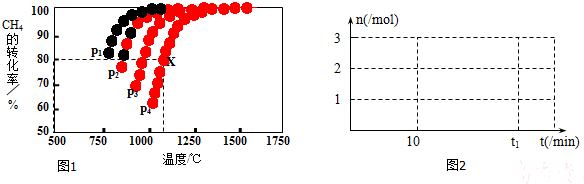
据图可知,p1、p2、p3、p4由大到小的顺序___.
(3)CO和H2还可以通过反应C(s)+H2O(g)═R1CO(g)+H2 (g) 制取.
①在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是___
A.体系压强不再变化
B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变
D.每消耗1mol H2O(g)的同时生成1mol H2
②恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=___.
若此时增大压强,平衡将向___(填“正”、“逆”)反应方向移动,t1min时达到新的平衡.
③请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图如图2.
(1)已知 ①2CO(g)+O2(g)=2CO2(g)△H1=-566 kJ•mol-1②2H2(g)+O2(g)=2H2O(g)△H2=-484 kJ•mol-1③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-802 kJ•mol-1根据盖斯定律,③-②-①得:CH4(g)+CO2...

