问题描述:
脱去冶金工业排放烟气中SO2的方法有多种.(1)利用本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成:
2H2(g)+O2(g)═2H2O(I)△H1=-572kJ•mol-1
2HI(g)═H2(g)+I2(g)△H2=+10kJ•mol-1
2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJ•mol-1
则得SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=___ kJ•mol-1
(2)氧化锌吸收法.配制ZnO悬浊液,在吸收塔中封闭循环脱硫.测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示.
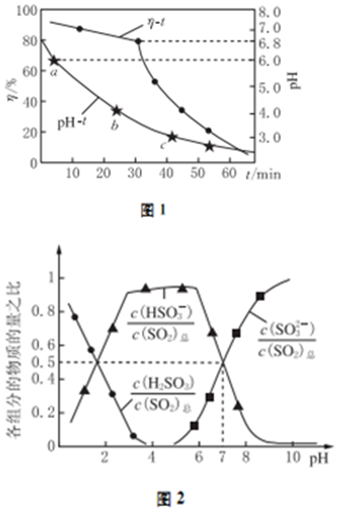
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、___.
②图1中的pH-t曲线ab段发生的主要化学方程式为___
③pH=7时,溶液中
| c(Zn2+) | ||
c(S
|
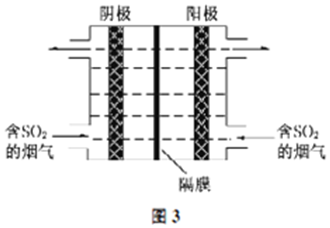
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4,以实现废物利用.
①阴极的电极反应式为___.
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为___、___.
(1)①2H2(g)+O2(g)═2H2O(I)△H1=-572kJ•mol-1②2HI(g)═H2(g)+I2(g)△H2=+10kJ•mol-1③2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJ•mol-1结合盖斯定律计算,(①+2×②+③)×12得到热...

