问题描述:
某化学小组的同学对呼吸面具的制氧原理非常好奇,为了测定呼吸面具中用来制取氧气的过氧化钠的质量分数,同学们在老师的指导下,利用如图所示装置(固定装置一略去)开展探究,并得到正确的结论.(假设药品中所含杂质即不溶于水也不参加化学反应)通过查阅资料得知,过氧化钠(Na2O2)分别能与二氧化碳和水反应,生成氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑和2Na2O2+2CO2═2Na2CO3+O2 装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物.整套装置气密性良好,反应所需试剂均足量.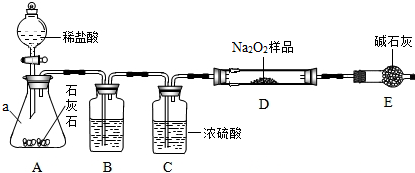
(1)仪器a的名称是___,装置A的作用是___;
(2)不用装置E代替装置C的理由是___.
(3)装置D中过氧化钠药品的质量为mg,装置D在反应前后的总质量n1 g和n2 g.则药品中过氧化钠的质量分数=___.
(1)由于图示可知,仪器a的名称是锥形瓶,由装置可知,装置A的作用是制取二氧化碳气体;
(2)由于装置E中的碱石灰能与二氧化碳反应,不能用装置E代替装置C.
(3)设过氧化钠的质量为x
2Na2O2+2CO2═2Na2CO3+O2 增加量
156 88 212 32 212-156=56
x n2g-n1g
| 156 |
| 56 |
| x |
| n2g-n1g |
| 156(n2g-n1g) |
| 56 |
药品中过氧化钠的质量分数为:
| ||
| mg |
| 1950(n2-n1) |
| 7m |
故答为:(1)锥形瓶,产生实验所需的二氧化碳;(2)碱石灰还能与二氧化碳反应;(3)
| 1950(n2-n1) |
| 7m |

