问题描述:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题: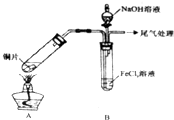
(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是___.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO
| 2- 4 |
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是___.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加___(添化学式)试剂,溶液立即出现蓝色沉淀.
| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___.
(1)FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,溶液显酸性,再加入NaOH稀溶液,先发生中和反应,然后再反应生成氢氧化亚铁,生成二氧化硫排尽空气,氢氧化亚铁不被氧化为氢氧化铁,现象为:开始无现象,然后产生白色沉淀,
故答案为:开始无现象,然后产生白色沉淀;
(2)Fe(HSO3)2+被Fe3+氧化为SO42-,Fe3+被还原为Fe2+,反应离子方程式为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+,
故答案为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(3)步骤①、②中Fe3+被还原为Fe2+,加入K3[Fe(CN)6]得到Fe3(Fe(CN)6)2蓝色沉淀,
故答案为:K3[Fe(CN)6];
(4)由步骤①可知,升高温度,反应速率加快,由步骤②可知提高FeCl3溶液的酸性会加快反应速率,
故答案为:升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.

